在剛過去的3月,國家藥品監督管理局有關醫療器械的公告及法規文件可謂密集發布,其在引發市場熱度的同時,也在刺激著業界的神經。
從熱度來看,“醫療器械臨床試驗審批程序調整”、“無菌和植入性醫療器械監督檢查”以及“93項行業標準制修訂項目計劃”三大重磅消息,無疑炸開了市場。而從時間節點來看,這三大公告或法規的發布,前后不過12天。
在回顧、總結2019年3月份醫療器械行業政策動向的基礎上,我們重點復盤了以上三大重磅政策,并匯總業界主要觀點,或附簡要點評。
醫療器械臨床試驗進入默許制時代
4月1日,國家藥品監督管理局發布《關于調整醫療器械臨床試驗審批程序的公告》,表示對醫療器械臨床試驗審批作出調整,進一步優化臨床試驗審批程序。
《公告》指出,申請人在提出臨床試驗審批申請前,可以根據《關于需審批的醫療器械臨床試驗申請溝通交流有關事項的通告》(國家食品藥品監督管理總局通告2017年第184號)與國家藥品監督管理局醫療器械技術審評中心進行溝通。自臨床試驗審批申請受理并繳費之日起60個工作日內,申請人在預留聯系方式、郵寄地址有效的前提下,未收到器審中心意見(包括專家咨詢會議通知和補充資料通知)的,可以開展臨床試驗。
對于同意開展臨床試驗的,器審中心將受理號、申請人名稱和住所、試驗用醫療器械名稱、型號規格、結構及組成在器審中心網站公布,并將審查結果通過器審中心網站告知申請人,不再發放臨床試驗批件。
其他關于醫療器械臨床試驗審批要求,按照《醫療器械注冊管理辦法》等相關規定執行。本審批程序自發布之日起施行。
點評
《公告》一出臺,業界媒體紛紛稱此舉“標志著我國醫療器械臨床試驗與國際接軌,醫療器械臨床試驗進入默許制時代”。
其實,在2018年底舉行的全國市場監管工作會議上,就有消息透漏,“2019年將優化醫療器械審評審批,加快創新醫療器械、臨床急需醫療器械審批上市”。
到3月28日,在北京召開的醫療器械創新發展與審評審批改革座談會上,國家藥監局又聽取了企業意見和建議,研究進一步鼓勵醫療器械創新發展工作思路。
普遍觀點認為,此次醫療器械產品臨床試驗審批再精簡,可使企業節省大量產品研發成本,同時時間成本也將大大降低,從而加速產品上市。此外,60天的默認期使得項目的可預見性極強,再加上項目預期投資回報率的提高,國產醫療器械企業的積極性也因此大大提高,這將有利于行業的良性發展,以及產業換代升級。
當前,我國醫療器械市場已初具規模,行業發展的“黃金十年”或將至。在國產化進程加快、產品多元化、市場集中化等行業背景下,醫療器械臨床試驗審批程序的變革,也被認為是與“醫療器械注冊人制度”配套的得力措施。尤其對于已試點注冊人制度的地區來說,創新醫療器械產品上市加速將更加明顯。
再掀監督檢查風暴:覆蓋無菌和植入性醫療器械全鏈條
3月27日,國家藥品監督管理局發布《國家藥監局綜合司關于進一步加強無菌和植入性醫療器械監督檢查的通知》(藥監綜械管〔2019〕25號),要求各省級藥監進一步加強無菌和植入性醫療器械監督檢查。
根據《通知》,檢查范圍將覆蓋無菌和植入性醫療器械生產、經營以及使用環節全鏈條環節。
在生產環節,由省級藥品監督管理部門組織對本行政區域無菌和植入性醫療器械生產企業開展監督檢查,重點檢查包括產品變更是否履行變更程序,特別是強制性標準實施后是否履行變更程序;是否建立與所生產產品相適應的醫療器械不良事件收集方法;是否及時收集醫療器械不良事件信息;對存在安全隱患的醫療器械,是否采取了召回等措施,并按規定向有關部門進行報告等10項內容。
在流通和使用環節,由市縣級負責醫療器械監督管理的部門對無菌和植入性醫療器械經營企業和醫療機構開展監督檢查。其中,流通環節包括是否未經許可(備案)從事經營(網絡銷售)醫療器械;是否經營(網絡銷售)未取得注冊證或者備案憑證的醫療器械;購銷渠道是否合法等7項內容;使用環節重點檢查對無菌和植入性醫療器械是否建立并執行使用前質量檢查制度;是否對植入和介入類醫療器械建立使用記錄,植入性醫療器械使用記錄是否永久保存,相關資料是否納入信息化管理系統,相關信息是否能夠追溯等。
《通知》明確,各省級藥監部門對植入性醫療器械生產企業每年開展不少于1次全項目檢查;各市縣級負責醫療器械監管的部門要抽取不少于15%的本行政區域的經營無菌和植入性醫療器械企業和醫療機構,開展經營使用環節的監督檢查。
檢查方式從企業自查開始。無菌和植入性醫療器械生產經營企業和使用單位在全面自查的基礎上,分別填寫自查表,5月底前上報有關部門。各省級藥品監督管理部門于2019年12月10日前將監督檢查總結報告的電子版和紙質版報送國家局。
點評
3月15日,FDA發布聲明稱,將變更醫療器械制造材料的審查制度。
該聲明發布原因在于,經過政府專員和學術界專家的評估討論,以及越來越多的證據表明,少數患者對植入式或可插入式裝置中的某些類型的材料有生物反應。如某些患者在醫療器械植入體內數年后,會因器械制造材料引起諸如疲勞、皮疹、關節和肌肉疼痛或虛弱等癥狀。
的確,如植入性醫療器械等,其更好造福患者的另一面,還依舊存在著重重隱患。
在國內,此前不久,國家藥品監督管理局醫療器械監督管理司司長王者雄介紹了2019年醫療器械監督管理重點工作安排。在王者雄司長的介紹中,“不斷完善醫療器械監管法規制度”、“強化生產監督檢查”、“加強經營使用監管”等將成為2019年重點工作。
《通知》一出臺,也就立刻引起業界廣泛關注。從“專項大檢查”、“合規風暴來襲”、“限期兩個月”、“重點檢查這幾項”等字眼來看,市場的重視和反應不難窺探。
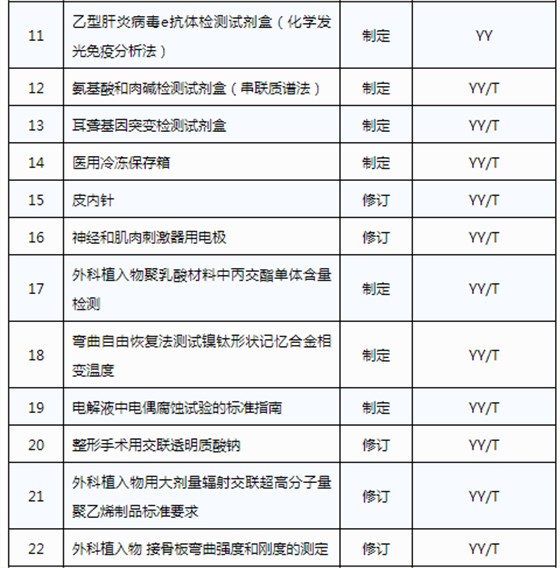
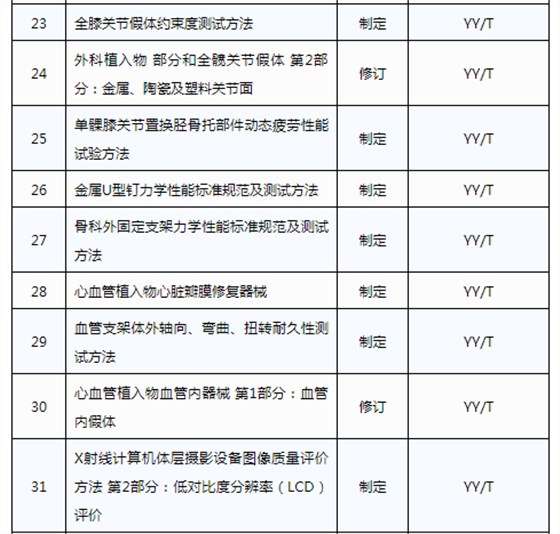
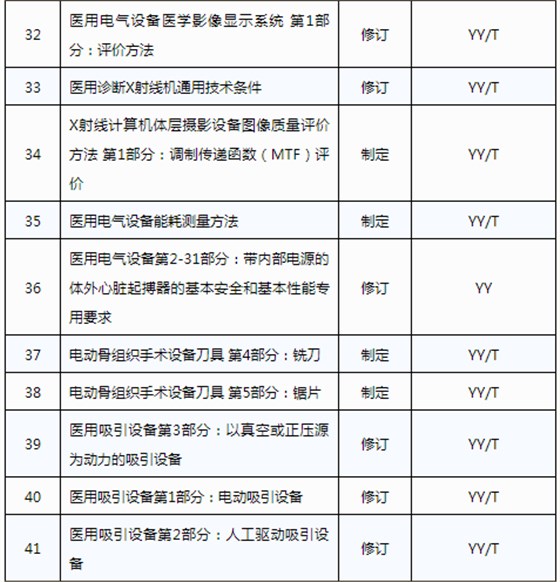
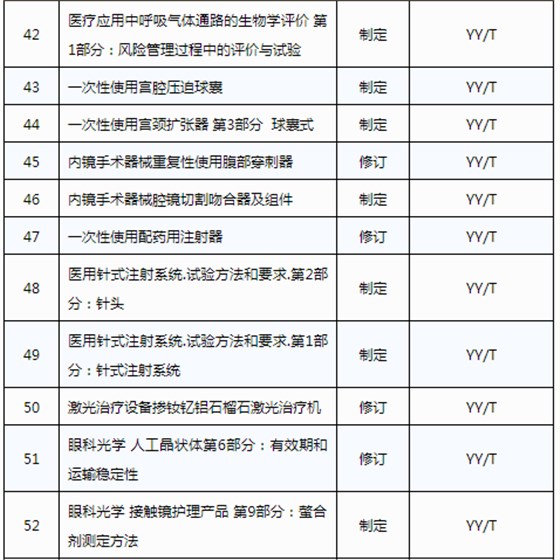
醫械93項行業標準制將修訂
3月20日,國家藥品監督管理局發布《關于印發2019年醫療器械行業標準制修訂項目計劃的通知》(藥監綜械[2019]23號)。
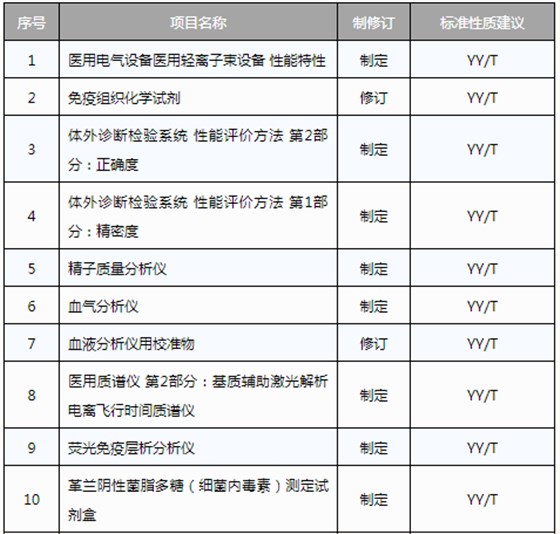
此前,國家藥品監督管理局組織開展了2019年醫療器械行業標準制修訂項目遴選工作。經公開征求意見和組織專家論證,此次《通知》確定了2019年93項醫療器械行業標準制修訂計劃項目,包括括聽診器、皮內針、醫用診斷X射線機通用技術條件等,具體項目如下:
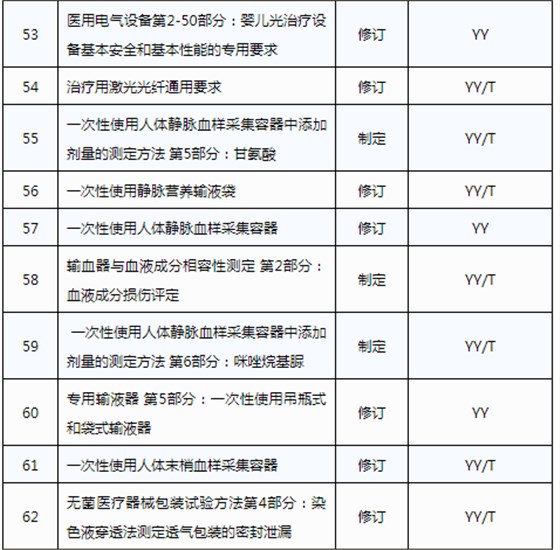
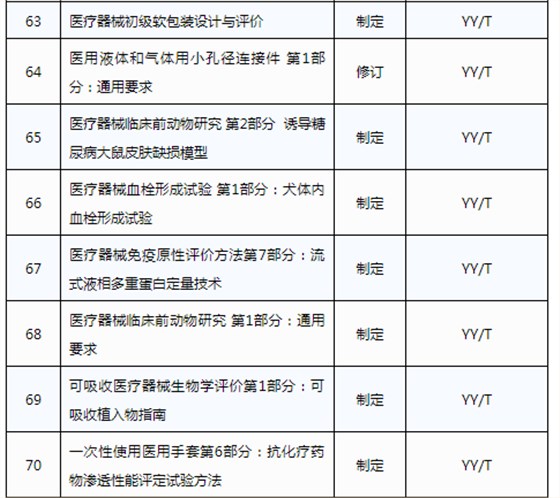
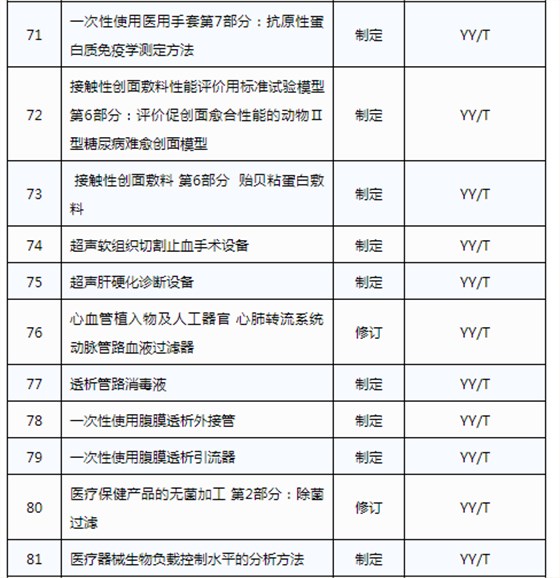
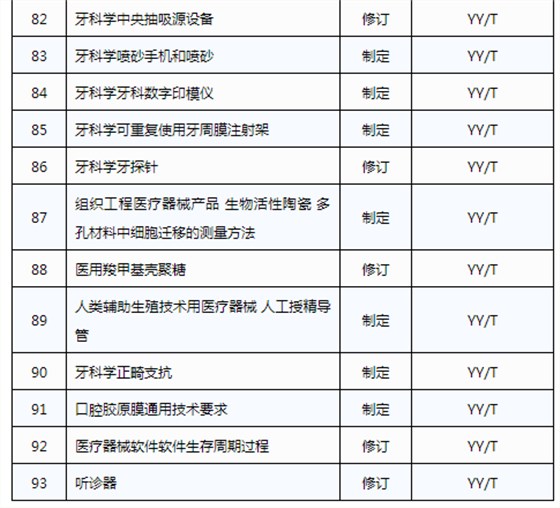

 耦合劑智能供料器
耦合劑智能供料器 隔離透聲膜
隔離透聲膜 腔道用超聲耦合劑
腔道用超聲耦合劑 醫用無菌耦合劑
醫用無菌耦合劑